创新药物临床、许可引进及产品上市相关准备
项目简介
项目总投资187,448万元用于创新药物的临床开发、商业化许可、许可引进项目研发里程碑支付及部分产品上市准备相关等后续费用。项目拟推进FCN-437、枸橼酸焦磷酸铁溶液(Triferic)、FS-1502、FCN-159、利拉鲁肽(Liraglutide)、SurVaxM(重组多肽疫苗)、Tenapanor(替那帕诺1)、Balixafortide(巴利福肽2)、干细胞治疗(CTX)、干细胞治疗(hRPC)、新型冠状病毒mRNA疫苗等的临床进展及部分项目的上市准备工作,并就SurVaxM(重组多肽疫苗)、Tenapanor(替那帕诺)、Balixafortide(巴利福肽)、干细胞疗法(CTX及hRPC)、新型冠状病毒mRNA疫苗的临床进展向对应授权许可方支付里程碑付款等后续费用。本项目涉及的许可引进项目均已完成相应的授权许可协议签署。

以Balixafortide(巴利福肽)为例,2020年8月,本集团与瑞士生物技术公司PolyphorLtd(以下简称“Polyphor”)签订了CXCR4拮抗剂Balixafortide独家许可协议。Balixafortide是一款CXCR4强效高选择性拮抗剂,CXCR4对肿瘤的生长、侵袭、血管生成、转移和对治疗药物的耐药性起着重要作用。美国FDA已于2018年授予该药物快速通道地位,用于与eribulin联合治疗此前已至少接受了两次化疗方案的HER2阴性转移性乳腺癌患者。
目前Polyphor正在就Balixafortide进行一项随机阳性对照、开放的全球多中心临床Ⅲ期研究。作为Polyphor的合作伙伴,本集团将与其共同在中国开发和商业化Balixafortide。此外据相关临床前模型显示,CXCR4拮抗剂可以增强不同抗癌疗法的活性,具有与其他多种药物在不同实体瘤适应症的联合治疗方案的巨大潜力,此次合作不仅丰富本集团在抗肿瘤治疗领域的产品线,同时也能够为市场尚未满足的临床需求提供更多的治疗选择。
关于新型冠状病毒mRNA疫苗,当前新冠肺炎在全球大流行,截至2021年3月22日,全球新冠肺炎现存确诊人数已超过2,500万,累计死亡人数已超过270万。新冠肺炎疫情的爆发不但严重冲击全球经济政治秩序,也对我国常态化的疫情防控造成了巨大挑战。具有科学有效预防效力和安全性的新型冠状病毒疫苗具有重大临床需求。2020年3月,本集团获得BNTX授权,在中国大陆及港澳台地区独家开发、商业化基于其专有的mRNA技术平台研发的、针对预防新冠肺炎的疫苗产品。2020年11月13日,本集团收到国家药品监督管理局(以下简称“国家药监局”)关于本集团获许可的新型冠状病毒mRNA疫苗BNT162b2用于预防新型冠状病毒肺炎的临床试验批准。
2021年1月,该疫苗已于中国香港获认可作紧急使用,并已于2021年3月被分别使用于中国香港、中国澳门的政府接种计划。截至本可行性分析报告公告之日,该疫苗在中国内地的II期临床试验也在有序推进中。本次非公开发行募集资金将帮助本集团加快推进该疫苗于中国大陆的II期临床试验,及GSP仓储、冷链物流等上市相关准备工作,有利于保障人民生命健康和生产生活秩序稳定。
本项目的实施,是继续推进本集团创新发展战略的又一举措,通过自主研发、合作开发、许可引进、深度孵化等多元化、多层次的合作模式,有利于提升本集团的研发效率,快速丰富产品线,降低研发风险,满足重大临床需求,增强本集团产品线的市场竞争力,进一步夯实本集团的整体竞争优势。
项目投资概算
本项目对应的投资概算如下:
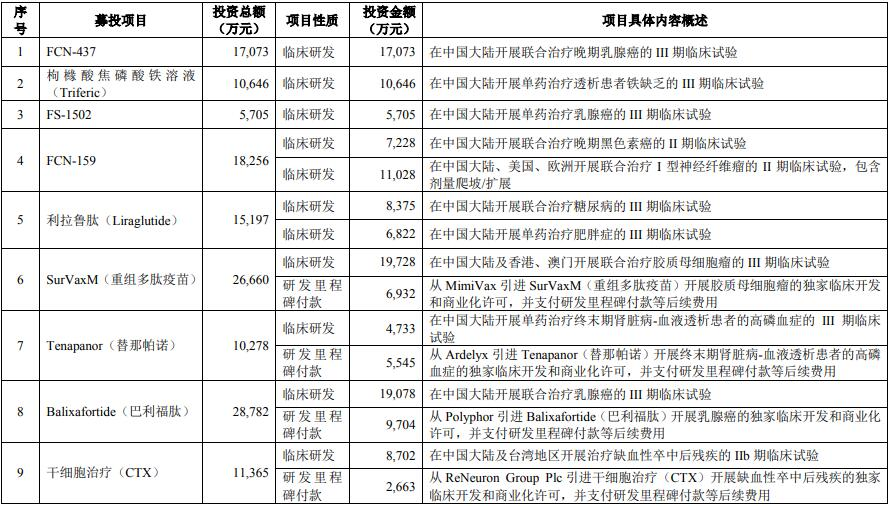
注:上述各研发项目和研发项目内不同适应症之间的投入可根据本集团临床研究进展和实际情况所需进行适当调整。
项目建设必要性
(1)政策利好,顺应创新药行业发展趋势
近年来,中国出台了多项政策来促进中国创新药产业的发展。《药品注册管理办法》从分类的重新定义可见,中国药品注册管理的关注点正在向创新药倾斜。《临床急需药品附条件批准上市技术指导原则》、《突破性治疗药物工作程序》、《优先审评审批工作程序》、《关于鼓励药品创新实行优先审评审批的意见》等文件的出台为创新药审批效率的提升提供了政策支持。
此外,针对仿制药出台的一系列政策,例如2018年4月国务院发布的《关于改革完善仿制药供应保障及使用政策的意见》及2019年6月国家卫生健康委员会(以下简称“国家卫健委”)发布的《第一批鼓励仿制药品目录建议清单》,明确促进有临床需求/科学依据的仿制药的发展,亦在一定程度上鼓励了真正具有创新价值的药品研发。2020年,与《药品管理法》相配套的《药品注册管理办法》、《药品生产监督管理办法》等规范先后发布,完善上市许可持有人(MAH)主体责任及相关制度,修订完善化学药、生物药、中成药等的各项研发技术规范及注册管理,继续改革优化审评审批制度及生产管理等内容,支持以临床价值为导向的药物创新。
创新药的研发是推动医药企业发展的重要动力,也是现阶段中国重点支持的领域,政策的大力支持使得中国创新药市场将进入快速发展通道。随着中国医药行业的不断发展以及创新药、集中采购等政策的影响,制药企业的业务重心逐步从过去的仿制药向创新药转型,尤其是行业内规模较大的医药公司,正逐渐加大创新药的研发投入,以维持其在医药行业的市场地位。在此背景下,本集团有必要加大创新药的研发力度,巩固本集团在业内的竞争优势,提升企业的核心竞争力。
(2)开拓创新药研发,解决临床需求
本项目中的产品涉及恶性肿瘤、代谢性疾病、消化系统疾病、预防新冠肺炎等适应症领域,属于市场临床需求大、成稳定增长趋势的病症,本项目的推进能够为患者带来新的治疗及预防手段,改善患者用药需求。本项目的实施有助于加快相关品种在国内的研发及产业化进程,满足重大临床需求,本集团在抗相关领域已积累多年的研发经验,并拥有多款产品已经上市,本项目的实施有利于增强本集团相关产品线的市场竞争力。
(3)完善自主研发、合作开发、许可引进、深度孵化的研发体系,加速创新转型和产品迭代
本集团依托自有的全球资源网络和国际研发平台,打造开放式创新研发生态,通过自主研发、合作开发、许可引进、深度孵化不断扩充产品线,同时依托多年根植产业所累积的临床注册、市场准入及学术推广能力,有效实现创新品种落地及商业化,从而建立高效、可持续的创新研发体系。
本次非公开发行募集资金投入到临床试验及里程碑支付当中,将加快本集团创新转型和产品迭代的进程,不断完善本集团的开放式研发生态,强化本集团核心竞争力,确保本集团业绩的长期增长。
项目投资可行性
(1)医药产业政策的支持
创新研发是医药产业发展动力,政策支持鼓励和保障是关键。在药物研发方面,国务院和相关部委先后发布了《罕见病诊疗指南(2019年版)》、《第一批鼓励仿制药品目录》、《第三批鼓励研发申报儿童药品清单》、《第二批临床急需境外新药名单》,为药品创新研发指出品种方向。中国在创新支持方面围绕“科技重大专项”也提前开展布局,国家卫健委科教司先后印发《关于组织重大新药创制科技重大专项2020年度课题申报的通知》、《卫生健康“十四五”规划前期研究重大课题征集公告》、《科技重大专项相关工作规则及管理办法的通知》等政策文件,进一步优化完善政府支持鼓励医药创新的机制和举措。中国医药产业政策的支持为本项目的实施提供了良好的政策保障。
(2)持续研发创新
本集团以制药为核心,坚持并不断优化发展战略,在做好现有业务及产业升级的基础上,专注投入在疗效确切、符合现代医学发展导向的领域,坚持提升早期研发和后期产业化开发能力,不断加大研发投入,2020年度本集团研发投入共计40.03亿元,较2019年度增长15.59%。
目前,本集团已形成了国际化的研发布局,具备较强的研发能力,在中国、美国、印度等建立了互动一体化的研发体系并打造小分子创新药、抗体药物、细胞治疗等国际研发平台,此外,秉承开放合作,还通过自主研发、合作开发、许可引进、深度孵化等多元化、多层次的合作模式对接全球优秀科学家团队、领先技术及高价值产品,推动创新技术和产品在全球的开发和转化落地。本集团持续的研发创新为本项目的实施奠定了坚实的基础。
(3)雄厚的技术储备及强大的研发实力
本集团以创新研发为核心驱动因素,通过自主研发、合作开发、许可引进、深度孵化的方式,布局国际化高水平并具有成本优势的研发及制造体系,通过多层次创新,持续优化产品结构,完善产品布局,加快推进一线治疗药物的上市。
截至2020年12月31日,本集团主要在研新药、仿制药、生物类似药及仿制药一致性评价等项目247项,制药板块专利申请达176项,其中包括美国专利申请12项、PCT申请16项,获得发明专利授权70项。通过持续的研发创新,本集团形成了雄厚的技术储备,为本项目的顺利实施提供了有力支持。
医药的研发创新需要专业的研发团队,人才是本集团求生存、谋发展的关键因素,本集团高度重视高素质研发人才的外部引进与自主培养,经过多年的发展,建立了一支专业素质过硬、年龄结构合理、行业经验丰富的研发团队,截至2020年年末,本集团拥有研发人员近2,300人,在小分子创新药、抗体药物、细胞治疗等领域拥有丰富的研发经验,能够为引进项目的后续研发和顺利产业化提供有力支持。
(4)与合作方协作良好,已具备成熟的产品临床注册能力
在自主研发、合作开发、许可引进、深度孵化的研发体系下,本集团通过多年深耕,与各合作方均协作良好,已经具备了成熟的与合作方共同开发产品、推进临床进展、药品注册上市等全流程合作的能力。
以马来酸阿伐曲泊帕片为例,本集团于2018年3月获美国AkaRxInc.关于该产品在中国大陆及香港特别行政区的独家销售代理权的许可,并于2020年4月收到国家药监局关于马来酸阿伐曲泊帕片的《进口药品注册证》,批准该新药适用于择期行诊断性操作或者手术的慢性肝病相关血小板减少症的成年患者。
就本次非公开发行募投项目而言,以新型冠状病毒mRNA疫苗为例,2020年3月,本集团获得BNTX授权,在中国大陆及港澳台地区独家开发、商业化基于其专有的mRNA技术平台研发的、针对预防新冠肺炎的疫苗产品。在此基础上,本集团积极开展了候选疫苗产品的临床推进工作,就BNT162b1于2020年7月获国家药监局临床试验批准,截至本可行性分析报告公告之日,已完成I期临床受试者接种程序,现处于数据统计分析过程中。BNT162b1的研发使本集团积累了疫苗临床试验的经验和团队,为开展BNT162b2研发奠定了良好的基础。
于2020年11月13日,本集团获得了国家药监局关于同意BNT162b2用于预防新冠肺炎的临床试验批准。2021年1月,该疫苗已于中国香港获认可作紧急使用,并已于2021年3月被分别使用于中国香港、中国澳门的政府接种计划。截至本可行性分析报告公告之日,该疫苗在中国内地的II期临床试验也在有序推进中。
(5)强大的商业化能力
截至2020年12月31日,本集团持续强化营销体系的建设与整合,已形成与现有产品及拟上市产品相配套的分线营销体系,并秉承专业化、品牌化及数字化的战略方向。截至2020年12月31日,本集团商业化团队近6,000人,围绕主要产品线划分为多个事业部,覆盖超过2,000家三级医院,10,000家一、二级医院。尤其在近两年,为了配合创新产品的上市及国际化进程,本集团着重打造了创新药商业化团队、OTC及线上渠道的新零售团队、非洲及欧美商业化团队,并且在医学事务、市场准入、品牌推广等方面构建及完善了全方位的支持体系。
项目实施主体
本项目的实施主体包括本公司全资子公司上海复星医药产业发展有限公司、江苏万邦生化医药集团有限责任公司、锦州奥鸿药业有限责任公司和FosunPharmaceuticalAG。
项目涉及报批事项情况
本集团将积极推进本项目涉及的相关报批事项。